吉利德与TROP ADC的忧郁
来源:同写意/写意君
要论当下制药赛道热度,ADC绝对名列前茅。而在ADC一众靶点中,尤其是尚未形成红海的机会洼地,TROP2自是占有一席之地。
有目共睹,TROP2已吸引了众多药企布局,但由于该靶点下游信号通路和功能复杂,且表达具有明显的瘤内异质性,药物开发难度较大,失败案例并不少见。比如,顶着“首款TROP2 ADC”之名的Trodelvy,就在开疆拓土中受挫了。
1月22日,吉利德宣布,EVOKE-01研究未达到总生存期(OS)的主要终点。这项III期临床旨在将Trodelvy与多西他赛对比,治疗经治转移性或晚期非小细胞肺癌(NSCLC)患者。
可以说,NSCLC上的失败为吉利德带来不小的“麻烦”——股价跌去10%,多少说明市场预期。乳腺癌和NSCLC这两大癌肿,是Trodelvy走向“大药”的重要据点。去年2月,Trodelvy好不容易在乳腺癌取得突破,可面对竞争对手Enhertu的狂飙突进,吉利德不得不继续求生。
Jefferies分析师就Trodelvy表示惋惜,这次试验失败,是对吉利德该药物研发计划的又一次打击,可能减少投资者对吉利德在抗肿瘤药物销售方面的信心。
但必须指出,NSCLC不仅是吉利徳一家需要跨越的门槛,背后可能是更大的产业挑战。此前,同样在NSCLC上进展坎坷的,还有阿斯利康和第一三共开发的Dato-DXd,也遇到在OS上获益不明显的问题。
尽管如此,仍有药企摩拳擦掌,跃跃欲试。本土Biotech科伦博泰开发的SKB264,似乎获得了更多的认可。但在跨越成药的“死亡之谷”之前,永远不乏变数。
首款TROP2 ADC
EVOKE-01研究中,Trodelvy与对照组相比,OS有数据上的优势,但没有达到统计学显著。
吉利德指出,OS获益主要由对PD-(L)1应答不佳的患者驱动。对于PD-(L)1不响应的患者亚组,OS有超过3个月的延长。但对于PD-1(L)1响应的患者亚组,OS没有区别。吉利德计划进一步探索Trodelvy对这部分患者的临床价值。
对于这次失败的原因,也有其他观点认为,吉利德试验的受试者为铂类化疗和免疫检验点治疗后进展的后线患者,实际纳入的大部分为EGFR野生型患者,EGFR突变患者较少,整体应答率不高,导致总人群的OS获益不明显。
目前,更多信息和具体情况,还需要等待吉利德的“官宣”。
Trodelvy是全球首款获批的TROP2 ADC,最初由Immunomedics开发。2020年9月,吉利德以210亿美元收购Immunomedics,将Trodelvy收入囊中。
而就在吉利德收购的前一年,云顶新耀以6500万美元的预付款及7.7亿美元的里程碑款,从Immunomedics手中拿下了Trodelvy在中国、韩国及部分东南亚国家的独家权益。因此,2022年吉利德收回上述地区的权益时,还要向云顶新耀支付最高3.3亿美元。
TROP2是新兴的乳腺癌治疗靶点,在三阴性乳腺癌、HR+/HER2-乳腺癌患者中表达非常高。而对于胰腺癌、肺癌、乳腺癌、子宫癌和卵巢癌等肿瘤,TROP2也被认为处于高表达状态。Trodelvy通过单抗sacituzumab与TROP2表达的肿瘤细胞结合,连接子CL2A水解释放毒素,毒素抑制DNA拓扑异构酶I,造成DNA单链断裂,导致DNA损伤,引起肿瘤细胞死亡。
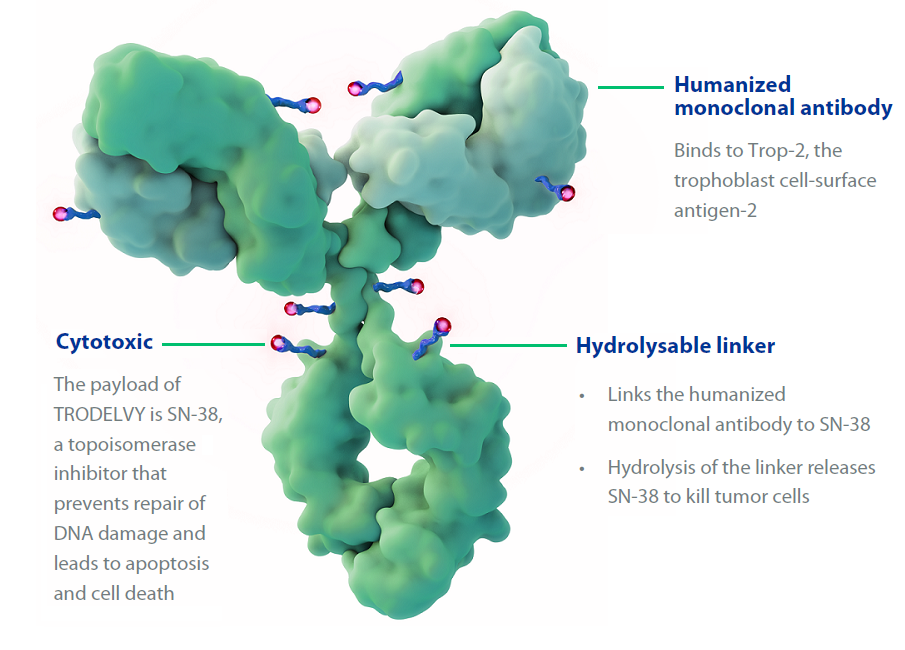
Trodelvy示意图,图源:Biotech前瞻
2020年4月,Trodelvy获得FDA加速批准,用于二线或以上治疗转移性三阴乳腺癌(mTNBC)成人患者,成为全球首个获批用于治疗三阴乳腺癌的ADC。
之后,吉利德在一项名为ASCENT的临床III期研究中,证实了Trodelvy用于mTNBC患者的二线或以上的治疗效果。由此,Trodelvy转为完全批准。2021年4月,Trodelvy第二项适应症也获得FDA的加速批准,用于治疗含铂化疗和PD-(L)1抑制剂治疗后的局部晚期或转移性尿路上皮癌。
2022年6月,经NMPA批准,Trodelvy获批用于既往至少接受过2种系统治疗,其中至少一种治疗针对转移性疾病的不可切除的局部晚期或转移性三阴乳腺癌成人患者。
2023年2月,Trodelvy的第三项适应症获得FDA批准,用于治疗不可切除的局部晚期或转移性激素受体阳性、HER2阴性乳腺癌成年患者,要求这些患者在转移后接受过内分泌治疗和至少2种其他全身性治疗。
截至目前,Trodelvy已在美国、欧盟、澳大利亚、加拿大、中国、新加坡等三十多个国家上市。
Trodelvy首个完整年度业绩为3.8亿美元。2022年,该药销售额为6.8亿美元,同比增长78.9%,营收位列全球ADC的第五位。2023年前三季度,Trodelvy销售额为7.64亿美元,同比增长58%。
吉利德曾预计,2023年全球销售额将突破10亿美元。随着新适应症的开拓,Trodelvy或许将用三年时间,成功跻身“重磅炸弹”队列。
只不过,EVOKE-01的失败,令吉利德不得不有所调整。这家巨头还没有放弃尝试其他可能,例如,Trodelvy联合pembrolizumab的II期EVOKE-02,以及一线转移性PD-L1高NSCLC的III期EVOKE-03,吉利德对这些研究仍然充满信心。
馅饼,还是陷阱?
“得肺癌者得天下”一词并非空穴来风。
作为全球第一恶性肿瘤疾病,Datamonitor Healthcare曾预测,至2027年,每年新发肺癌患者可达190万人。市场规模也一路狂飙,预计到2025年将达到1000亿美元。肺癌已然成为了肿瘤免疫治疗在乳腺癌之外开辟的第二主场。
公开数据表明,全球已上市肺癌相关药物超过百种。其中,帕博利珠单抗、纳武利尤单抗、阿替利珠单抗等免疫药物,占据全球肺癌药物的半壁江山。
囿于靶向耐药与免疫应期短、“内卷”等问题遇冷,包括吉利德在内的全球制药公司,都将目光转向更火热与更大空间的ADC肺癌领域。某种程度来说,多家巨头涌入,也可看作是ADC领域的“PD-1周期”——量变引发质变后,看的是,谁能在大浪淘沙之中活下来。沉淀下来的,势必就是闪闪发光的金子。
行业内还有一种看法,此次试验并非Trodelvy的终点——“失败并不完全令人意外,因为其他TROP2 ADC在早期研究中的数据也好坏参半”。尽管该行业对ADC充满热情,但安全问题仍不可忽视,尤其是间质性肺病(ILD)。
去年7月,另一款TROP2 ADC Dato-DXd,在治疗晚期NSCLC的III期临床中期分析数据显示,只达到了一个临床终点,并可能存在安全性问题。具体来看,该药只达到了PFS主要终点,OS数据不成熟,并没有达到统计学显著改善,且观察到7例ILD(并未直接表明,通常为ILD)。
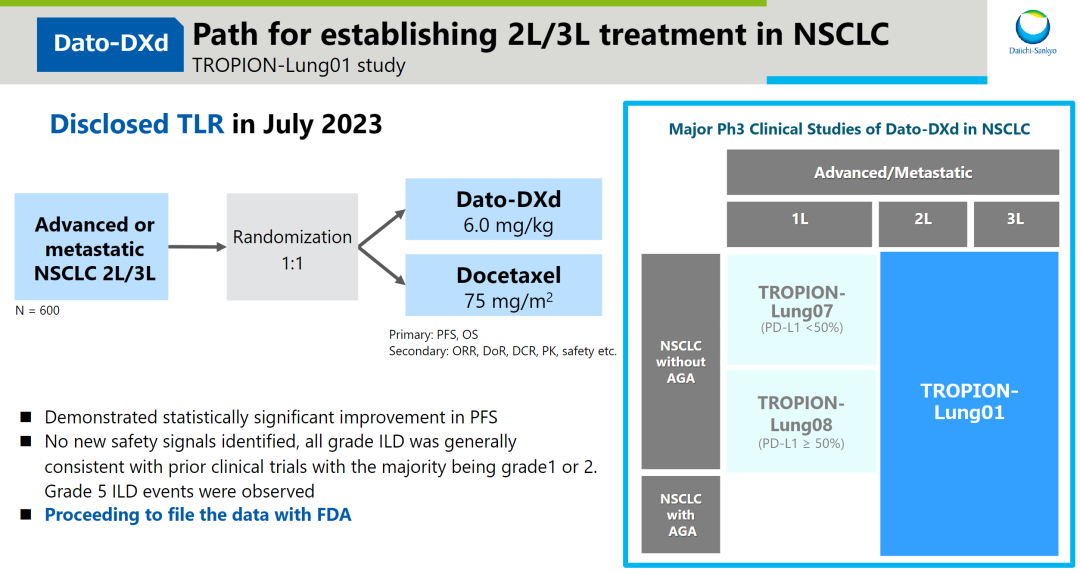
图片来源:同写意
据悉,Dato-DXd来自阿斯利康和第一三共,其联合开发的Dato-DXd是采用第一三共专有的DXd ADC技术设计的TROP2 ADC药物,目前正在开展TROPION系列临床开发计划,并已有多个NSCLC和乳腺癌适应症处于III期临床。如果Dato-DXd获批,有望成为两家巨头的又一重磅营收抓手。
值得一提的是,在Trodelvy的EVOKE-1研究的601名患者中,还尚未出现该类安全问题。
如今来看,想走出“PD-1周期”的吉利德为保证Trodelvy商业化未来,还要加速步伐。视线收回国内,挑战者更是“人从众”。
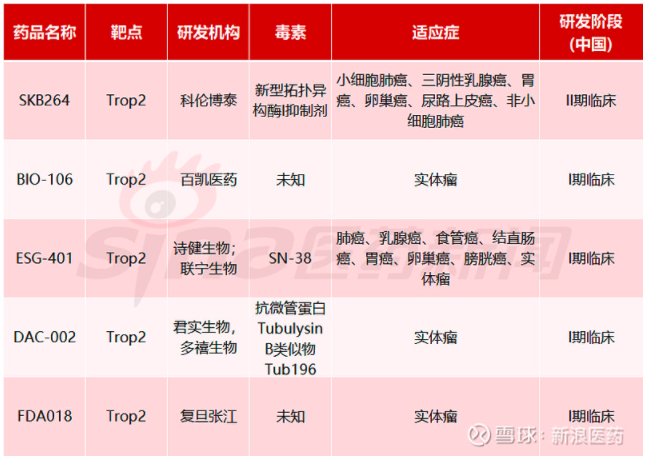
国内TORP2 ADC布局情况 图源:新浪医药
其中,由科伦博泰开发的SKB264是最有希望成为国产首款上市的TROP2 ADC药物。
2022年5月,该公司与默沙东达成合作,并于7月进入临床III期阶段,同年11月,其NSCLC适应症就获得中国优先审评资格。去年10月,默沙东注册了该药的NSCLC国际III期临床,预计2027年完成。
有行业人士称,相比于Dato-DXd,SKB264更加有看头,并直言,“Dato-DXd不达预期是适应症没有选好,单药做NSCLC三线的全人群有点过于激进”;SKB264则以收治人群与毒素结构不同,进而规避掉相关的风险,实现“逆袭”。
但行业需要看到,面临着疗效和安全性的双重考验,相比更成熟的靶点,TROP2 ADC的道路还充满着不确定性。科伦博泰之外,更早一批入局的Biotech多已不声不响。
此次Trodelvy的失败,究竟是给后来者让位,还是一整个赛道沉沦的开始?或许,答案不需要等待多久。
参考文章:
1.Trodelvy(TROP2 SN38)非小细胞肺癌失守,EGFR,cMET,HER3成NSCLC热门竞争靶点;Antibody Research
2.洞见研报
3.Gilead's Trodelvy fails to extend survival in lung cancer study, prompting selloff;fiercepharma
4.TROP2 ADC非小III期丨吉利德失败,第一三共OS不显著,压力给到科伦;Biotech前瞻
5.吉利德TROP2为何在NSCLC失败;蓝精灵壹号
声明:本文系神州医药网转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与我们联系,我们将在第一时间删除内容!
上一篇:儿童疫苗江湖
下一篇:2024年医药的第一颗雷
推荐资讯
神州医药热门单品推荐

- 2024第五届西藏医疗器械及大健康产业展览会
- 主要产品:
- 热度:

- 了解详情

- 2024香港国际生物科技展览暨论坛
- 主要产品:
- 热度:

- 了解详情

- 2024第32届广州国际大健康产业博览会
- 主要产品:
- 热度:

- 了解详情

- 2026第35届【北京】中国国际健康产业博览会
- 主要产品:
- 热度:

- 了解详情

- 2026第20届上海国际养老与辅具及康复医疗博览会(AID老博会)
- 主要产品:
- 热度:

- 了解详情
- 医药资讯
- 涨超120%的皮炎明星药,17家药企竞逐国产第3家
- 获批!国产改良型新药,登陆美国
- 又一1类新药获批上市!销售收入有望超60亿
- 彭水俊苗山医药研究院
- 今年1—7月,职工医保个账家庭共济金额达227亿元
- 关于做好2024年城乡居民基本医疗保障有关工作的通知
- 中药面包、中药冰淇淋…是养生还是智商税?专家提醒
- 十八次方干膜上市
- 国家卫健委:全面推进紧密型县域医共体建设
- 国家药监局综合司关于印发药品监管人工智能典型应用场景清单的通知

网站备案号:琼ICP备2022001664号-24 增值电信业务经营许可证:琼B2-20221748
神州医药网郑重提示:本网站只起到信息平台作用,不对交易行为负担任何责任,请自行核实,谨慎行事。
任何单位及个人不得发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息。
联系电话:400-101-5699 手机:18815323799(同微信)(只提供招商信息服务,不卖药) 客服微信/QQ:3331677131 邮箱:shenzhouyibo@126.com
 琼公网安备46010002000141号
琼公网安备46010002000141号
























点击留言(留言后专人第一时间快速对接)
已有 1826 企业通过我们找到了合作项目