干货!FDA高度关注:药企如何做潜在诱变杂质管理?
自2019年沙坦亚硝胺污染事件后,FDA和EMA明显加大了对药品潜在诱变杂质的监管力度。不仅屡次发文至其监管的制药公司与CDMO,而且为很多药物基质亚硝胺杂质设定了非常严格的ADI(每日允许摄入量),例如18ng/天。
亚硝胺风波尚未平息,苯污染又成为了监管机构鸣响的另一次警笛。
药品生产过程中使用或产生的很多物质都有可能是潜在诱变杂质(PMI),例如很多烷基化试剂,包括氯代烷烃,它们的使用,或者作为杂质产生于反应的过程中,都可能给药物带来PMI污染的风险。面对产品安全与PMI管理的可操作性,从业者需要一种合理的手段实现两者之间的平衡。
本文将着重介绍PMI的purgefactor与purgeratio概念,它们的计算方法,以及随之而来的PMI控制方法。
01
什么是PurgeFactor
PurgeFactor(PF)反映工艺降低杂质水平的能力。根据ICHM7(R1),它被定义为工艺上游点的杂质水平除以工艺下游点的杂质水平。PF既可以通过测量也可以通过预测的手段实现(PS:需要提前强调的是,PurgeFactor和PurgeRatio是两个不同的概念,下文将具体介绍两者的差别和联系)。
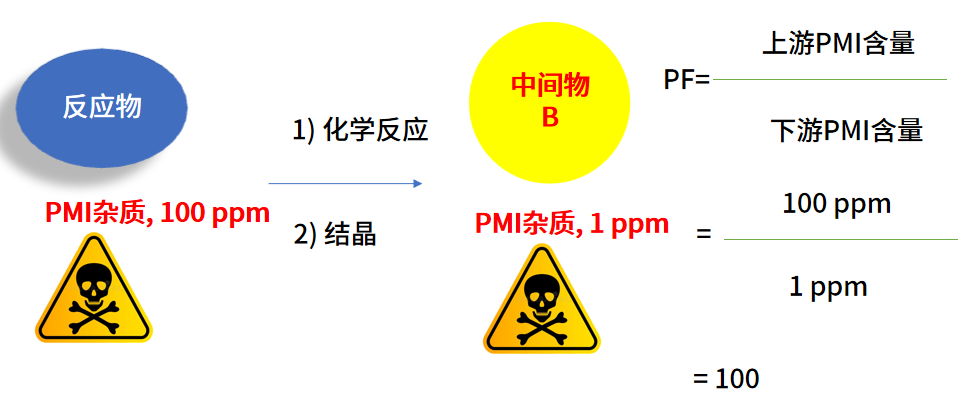
02
PurgeFactor(PF)计算:基本原则
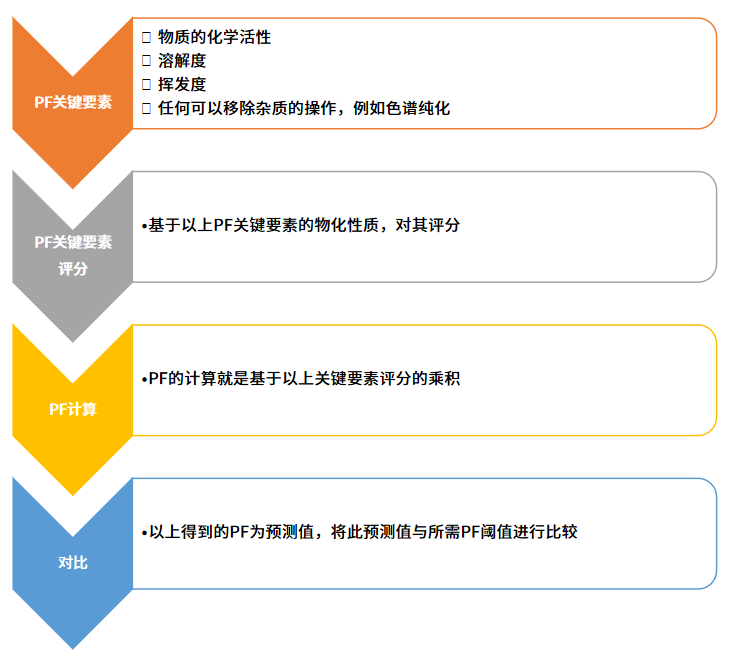
PF的计算值是根据目标的潜在基因毒性杂质,或潜在诱变杂质(PMI,potentialmutagenicimpurity;或PGI,potentialgenotoxicimpurity)的自身物理化学性质,以及所处工艺的特征共同决定的(步骤如下图所示)。
第一步是评价可以决定PF的清除程度的关键要素,例如它的反应活性、溶解度、挥发度,以及能够将其排除出体系的工艺操作,例如色谱纯化;
第二步是根据这些特性,对他们进行评分;
第三步是PF的计算,即将上述评分乘积;
第四步对比所得的预测PF和所需PF阈值,以决定PMI最终污染产品的可能性。
注:
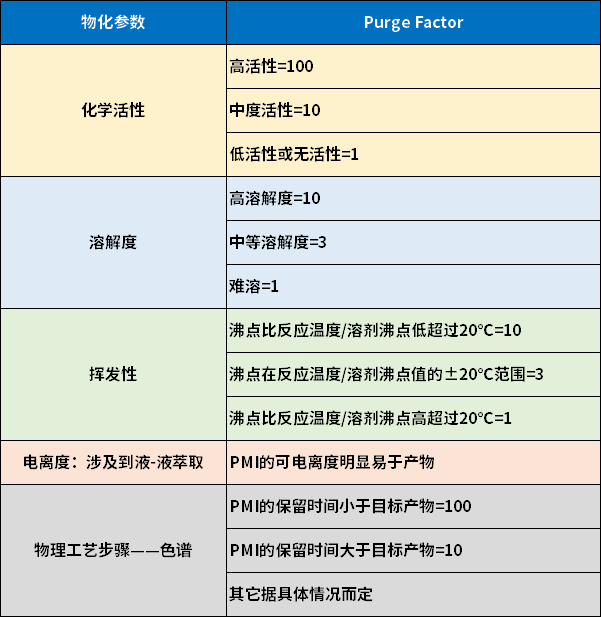
PMI的化学活性评分可分三个档次:1,10,100。该评分可以通过已存在的实验数据,或者参与评分者的知识体系决定。
PMI的挥发度是基于所在溶剂的沸点与PMI的沸点比较给出的。
PMI的溶解度是基于PMI形成于反应体系,因此会保留在母液这个考虑做出的,但要考虑以下因素(保守估计):
1.PMI在纯溶剂中的溶解度,与反应结束时,或者workup时的情况可能不一致;
2.结晶过程可能没有得到很好的控制,因此PMI即便在母液中具有较高溶解度,也有可能与产物共同析出。
以上的评分体系,大的原则倾向于保守估计PMI的PF。
表1.PF评分系统ICH指南
03
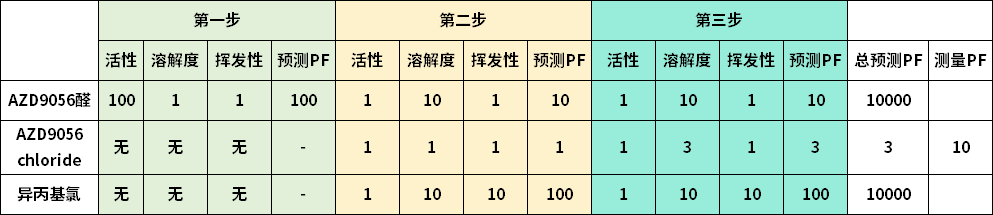
案例分析:AZ9056醛
制备AZD9056HCl的工艺,使用了AZD9056醛作为反应物。考虑到这个反应物含有醛基,因此它可能成为最终产物中的PMI。该工艺过程如下图所示。
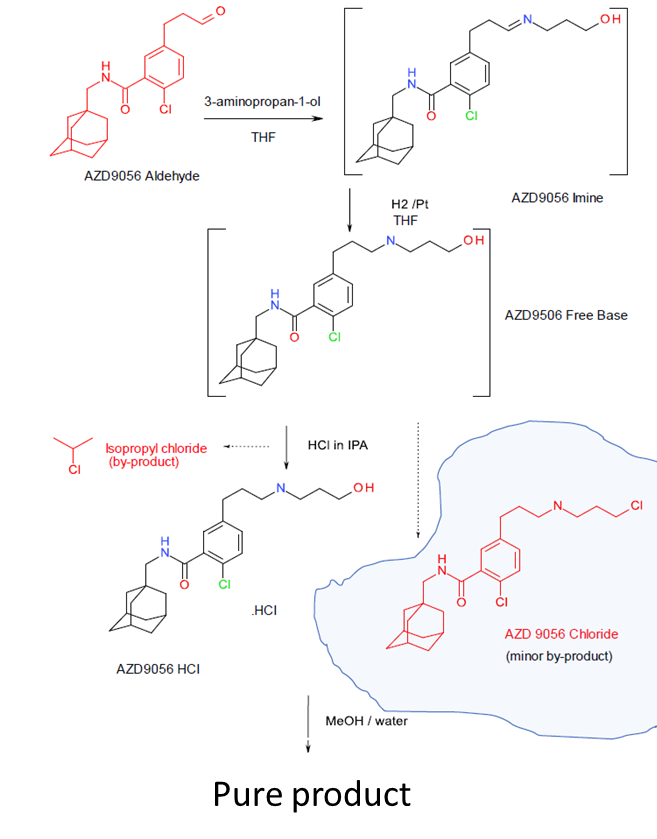
AZD9056HCl合成路线
图片来源:LhasaLimited
第一步:还原胺化
化学活性:100(基于工艺控制,例如反应转化率)
溶解度:1(没有中间物分离过程,因此没有清除效果)
挥发度:1(不挥发)
第二步:HCl盐分离
化学活性:1
溶解度:10(目标产物AZD9056HCl被分离,残余醛保留在溶液中)
挥发度:1
需要注意的是,除了反应物醛AZD9056之外,这个工艺中还产生了两个潜在的遗传毒性杂质:异丙基氯(isopropylchloride)和AZD9056chloride。他们都是烷基氯代化合物,因此从结构上看也属于PMI的行列,因此不能忽略,需要一并分析。
对于这三个筛选出来的PMI的PF评分详情见表2。可以看出,AZD90956醛和异丙基氯都具有很高的PF预测值。前者得益于多重步骤可以去除,这也解释了越下游的PMI产生,其危险性就越高的原因,例如沙坦事件中的亚硝胺杂质,就是产生在化学反应的最后一步。
异丙基氯尽管形成在第二步,但得益于其较低的沸点(因而挥发度得分较高),也取得了10000的预测PF。与此相反的是,AZD9056chloride的预测PF只有3。基于此潜在的高风险,研发人员通过测量的方式获取了其更为准确的PF,其值为10。至于这个数值是否可以保证AZD9056chloride的含量控制在相应的阈值之下,就需要结合具体的工艺,以及该药物的给药方式和剂量来进行评估和判断。
表2.AZD9056醛、AZD9056chloride和异丙基氯的PF预测
如何为活性打分
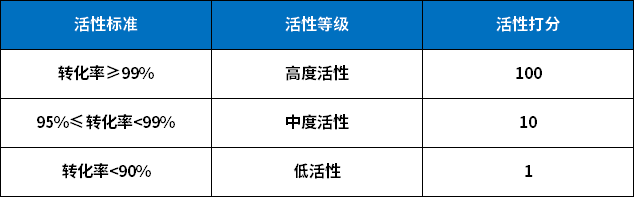
注:以上打分不仅要考虑反应过程,也需要将work-up步骤考虑进去。如果没有实验数据,也可以参考类似化合物或反应、参考文献,或者依靠专家经验。
如何为溶解度打分
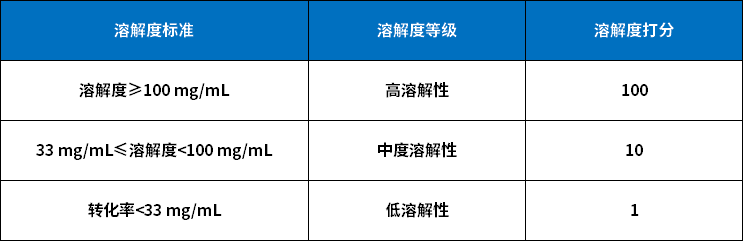
04
如何使用PF
上文已经提示过,PurgeFactor和PurgeRatio是两个既不相同又高度关联的内容。Purgefactor的计算,可以说是为了引出PurgeRatio做铺垫,而后者将是决定应该采用何种策略管理生产工艺中引入或产生的PMI的决定因素。
PurgeRatio的定义是“预测或测量的PMI的PF与所需要的PurgeFactor之间的商”。

这个定义中又引入了一项新的内容,即:需要的PF。那么什么是需要的PF?
简单地说,需要的PF就是保证最终药物中PMI含量达标的PF值。它的定义为:反应中PMI的最大浓度(ppm,比如PMI反应物完全没有转化,或者一个反应物完全转化为了一个PMI杂质的情况下的浓度)与API中该PMI所允许的质量标准(ppm)之间的商。

在ICHM7:ControlStrategyOptionforMutagenicImpurities一章中,对于如何控制PMI提出了四个选择,具体内容见下图。

ICHM7四种PMI的控制策略
从上图可以看出,四种选择是按照宽松度增加的顺序排列的。选择1需要在API中测量实际的PMI含量;选择2可以测量中间品,或者原料的PMI浓度,而且需要按照最终API的质量标准;选择3针对中间品,但可以放宽最高浓度限制,当然这是建立在对于工艺能力掌握的基础之上,以PurgeRatio作为依据进行的;选择4则无需做任何检测,这也是建立在对工艺了解的基础之上,而且PurgeRatio达到一个标准的前提下做出的决定。
具体来说,1000是PurgeRatio的一个分水岭:如果PurgeRatio大于1000的话,可以按照选择4的内容进行PMI控制,即无需做任何分析;当PurgeRatio小于1000的话,则要根据情况选择1-3的内容进行PMI分析。其决定树见下图。在关键的杂质是否被清除的标准上,采用的正是Purgeratio大于1000的原则。

是否需要测量PMI的决定树图
05
ICHM7关于PMI控制的示范
让我们通过一个案例来说明如何通过PurgeRatio的标准,来选择对于PMI的控制途径。
假设有一个PMI物质X产生于某个工艺,而这个PMI的身份是原料(尽管PMI的名称是潜在诱变杂质,但如果反应物就是具有诱变性的物质的话,那么在毒理学家眼里它就是个杂质)。
假设这个PMI物质X以1当量投入反应体系,并且初始浓度为106ppm。
为了实现X在最终API中的含量小于TTC100ppm(TheThresholdofToxicologicalConcern,毒理学关注阈值。如果人体对某种物质的暴露低于TTC值,则认为产生不利影响的可能性非常低),需要104的PurgeFactor(注意,是PF而不是PurgeRatio)。该值是通过106/100ppm得到的(参加上文Eq.2)。需要注意的是,这个算法中,假设了X完全保留下来,没有产生任何化学转化。这当然是一种最保守的估算方法,这个要求在上文也做了说明。
为了实现1000的PurgeRatio(此处是PurgeRatio)的阈值,预测出的X的PurgeFactor(此处又成了Purgefactor)必须大于107(即103=107/104,参见Eq.1)
如果预测的PurgeFactor(PF)值大于107,那么便可以选择ICHM7中的选项4,即不用对PMI做任何形式的测定;反之,如果PF小于107,则需要视具体情况而选择1-3的选项(也有某些Purgeratio小于1000而选择选项4的情况,见下文),测量产品、中间品或者原料中的PMI含量:
PurgeRatio > 1000(建议选择4)
不必需要收集额外数据来证明PMI控制;
在非商业API的监管报告中注明PMI“unlikelytopersist(不太可能保留)”;在商业监管报告中,标明预测的PF和PurgeRatio。
100 < PurgeRatio < 1000(建议选择4)
无论商业还是非商业监管报告,都应该提供额外的实验数据(溶解度、活性和挥发性数据);
无需提供PMI含量分析数据;
在递交非商业监管报告中,呈递预测PF和PurgeRatio值;
在商业监管报告中,呈递具体的PF计算过程,PurgeRatio计算过程,以及支持数据。
PurgeRatio < 100(选择1-3)
对于非商业化的API生产,建议提供实验确定的PMI清除数据,包括PMI含量分析;
如果PurgeRatio远小于100而仍然希望选择4的话,需要提供额外的实验数据以做支持;
提交非商业化API的监管报告时,需要提供预测PF值过程的关键参数、PurgeRatio的计算过程,以及支持性的数据,甚至PMI测定数据;
提交商业化API的监管报告时,需要提供上述的完整数据;
如果数据足够充分的话,可以使用选择4,否则将采取选择1-3。
Ref.
Borths,C.J.etal.ControlofMutagenicImpurities:SurveyofPharmaceuticalCompanyPracticesandaProposedFrameworkforIndustryAlignment.Org.ProcessRes.Dev.2021,25,831-837.
Elder,D.P.etal.IsAvoidanceofGenotoxicIntermediates/ImpuritiesTenableforComplex,MultistepSyntheses?Org.ProcessRes.Dev.2015,19,1437-1446.
Whyyoushouldconsidercontrollingyourpotentiallymutagenicimpuritiesoutsidethelab.LhasaLimited.
声明:本文系神州医药网转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容!
推荐资讯
神州医药热门单品推荐

- 2024第五届西藏医疗器械及大健康产业展览会
- 主要产品:
- 热度:

- 了解详情

- 2024香港国际生物科技展览暨论坛
- 主要产品:
- 热度:

- 了解详情

- 2024第32届广州国际大健康产业博览会
- 主要产品:
- 热度:

- 了解详情

- 2026第35届【北京】中国国际健康产业博览会
- 主要产品:
- 热度:

- 了解详情

- 2026第20届上海国际养老与辅具及康复医疗博览会(AID老博会)
- 主要产品:
- 热度:

- 了解详情
- 医药资讯
- 涨超120%的皮炎明星药,17家药企竞逐国产第3家
- 获批!国产改良型新药,登陆美国
- 又一1类新药获批上市!销售收入有望超60亿
- 彭水俊苗山医药研究院
- 今年1—7月,职工医保个账家庭共济金额达227亿元
- 关于做好2024年城乡居民基本医疗保障有关工作的通知
- 中药面包、中药冰淇淋…是养生还是智商税?专家提醒
- 十八次方干膜上市
- 国家卫健委:全面推进紧密型县域医共体建设
- 国家药监局综合司关于印发药品监管人工智能典型应用场景清单的通知

网站备案号:琼ICP备2022001664号-24 增值电信业务经营许可证:琼B2-20221748
神州医药网郑重提示:本网站只起到信息平台作用,不对交易行为负担任何责任,请自行核实,谨慎行事。
任何单位及个人不得发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息。
联系电话:400-101-5699 手机:18815323799(同微信)(只提供招商信息服务,不卖药) 客服微信/QQ:3331677131 邮箱:shenzhouyibo@126.com
 琼公网安备46010002000141号
琼公网安备46010002000141号
























点击留言(留言后专人第一时间快速对接)
已有 1826 企业通过我们找到了合作项目